
|
電子情報通信学会 - IEICE会誌 試し読みサイト
© Copyright IEICE. All rights reserved.
|

|
電子情報通信学会 - IEICE会誌 試し読みサイト
© Copyright IEICE. All rights reserved.
|

abstract
患者ごとに,また経時的に変化する病態を的確に診断しながら実時間で治療を最適化するフィードバック自動治療は,今後の医療の高度化に本質的であり,その実現には種々の要件(耐干渉性・通信速度・低遅延性・消費電力・伝送電力)を同時に満たした無線通信が重要な役割を果たす.高度な医療の実現には,無線通信に関する基礎研究に加え,生理学的研究の知見を駆使した情報の解析,ビッグデータ解析から得られる治療方法に関する知見を統合する必要がある.
キーワード:診断・治療,スパゲッティ症候群,フィードバック治療,無線通信,電磁両立性,ビッグデータ
高度な医療においては,情報の収集とその解析が極めて重要である.患者の状態を収集して解析し,総合的に判断することが病気の診断である(1).また治療の戦略は診断に基づいて論理的に行うべきであることから,正しい診断が得られなければ最適な治療には至らない.診断が確定しないために治療を始められないことさえもある.患者の状態が重症であればあるほど,そのために,多種多様な情報を,短時間ごとに繰り返し収集する必要がある.
生体の離れた部位から得られる様々な情報を集約し,また多種の医療機器の制御によって治療を行うことから,高度な医療においては多入力多出力のシステムによる制御が必要となる.生体の微弱なアナログ信号を局所で増幅し,多くはディジタル化して,情報を送受することが必要である.そのために情報の通信をいかに正確,迅速かつ安定に行うのかが重要な要素となる.また有線通信では物理的な混乱を生じることから無線での通信が必要となる.医療とヘルスケアに適した通信については多くの基礎研究が行われている(2).
本稿では,高度な医療ではフィードバック自動治療が本質的に重要でありその実現には種々の要件を備えた無線通信が必要であること,ヘルスケアや日常の医療で収集したビッグデータなしには新規の医療開発が困難になっていることを説明し,最後に高度な医療についての基礎研究の例について述べる.
4.の実例のように,重症患者で必要な次世代の高度な医療では,フィードバックによる自動治療が開発されると考えられる.逆に言えば,現在の医療ではまだフィードバック治療は本格的には実現されていない.
現在の薬剤を中心とした治療では,生体の異常を常時,一様に,正常方向に向かわせるものである.例えば高血圧では血圧を下げる薬剤治療を行うが,患者によっては血圧が下がり過ぎることもあり,また患者の中でも血圧が下がり過ぎる時間帯が生じることがある.すなわち病態のダイナミクスの治療(正常化)を行うものではない.実際に,高齢の高血圧患者では血圧の変動性が大きくなっており,変動性の大きな患者ではその後の治療成績が悪く,変動性をできるだけ小さくする治療が有効であることが知られている.
重症患者での治療では,現在は,医療関係者が短い間隔で異常値をチェックして治療の変更を行っている.このような人的資源を浪費するマニュアルのフィードバックは医療に限界をもたらしている.
フィードバックを用いた医療機器による自動治療では,生体の異常を監視して,正常の範囲内に制御することが可能であり,特に重症患者での治療では治療の精密化による治療成績の向上,医療関係者の省力化,薬剤使用量の節減などが期待される.
フィードバック自動治療では,前述のように,多種の情報を連続的に監視(モニタ)する必要がある.発生源が異なる多種のセンサモジュールからの情報は,別の解析モジュールに集約して診断を行う.また診断に基づき治療を行う機器の制御にも情報の伝達が必要である.多くのセンサモジュール,解析モジュール,治療機器との間を有線で接続することは現実的ではない.点滴注射や薬剤投与など,物理的にどうしても「有線」でなければならない接続があるため,情報の伝達については全て無線で行うことが必要である.しかし現在では無線通信で行える情報収集は限られており,患者と機器との間を多くの「有線」で接続することによって医療現場で混乱が起きている.この混乱はスパゲッティ症候群と呼ばれている.
医療現場では多くの電子的な医療機器が用いられ,電磁波の発生源となっている.またこれらの医療機器では他機器からの電磁波による誤動作を防ぐ必要がある.そのため複数の医療機器の間では電磁両立性を確保する必要があり,これは医療機器承認における重要項目の一つである.
一方で,無線通信で用いる電磁波によっても医療機器が誤動作しないこと,無線通信に対しても医療機器から発生する電磁波によって通信が妨げられないことが必要であり,無線通信と医療機器の間でも電磁両立性を確保することがある.
そのため,無線通信と医療機器との間の電磁両立性についても医療機器の承認をつかさどるPMDA(医薬品医療機器総合機構)を中心として行われている.新たな承認基準の策定を科学的に行うための検討はレギュラトリサイエンスと呼ばれている.
また多くのセンサモジュールから高頻度でほぼ同時に解析モジュールにアクセスするため,これらの間の耐干渉性も確保しなければならない.これらを考慮し,フィードバック治療で必要な通信では,広帯域の拡散通信が必須となる.
フィードバック治療では,各センサモジュールで測定される生体信号に応じ,必要な信号の帯域を保証するサンプリング周波数で測定を行い,その測定値を順次通信する必要がある.(次項で述べるよう,実際には許容される遅延にも上限がある.)
例えば,血行動態の時系列信号であれば,測定値当り通常100~500Hz程度での通信であり,それほど大きな通信速度は必要ない.脳波などの電気生理学的な時系列信号でも,10kHz程度での通信である.一方で,フィードバック治療に画像情報を用いることはまれであるが,画像情報を時系列で(動画像を)通信する必要がある場合には,高速の通信が必要となる.
制御工学の理論から,フィードバックの利得,速度,安定性を両立するためには,無駄時間による遅れを可能な限り減らすことが最も重要である.センサモジュールからの取得情報の通信,解析モジュールによる治療機器駆動のための通信による無駄時間遅れもこれに含まれるため,フィードバック治療で用いられる通信には,低遅延性が求められる.
フィードバック治療で用いられるセンサモジュールは情報の授受に無線通信を用いて,「線」のない機器とすることでスパゲッティ症候群を防ぐものである.しかし,商用電源を用いたのでは,この目的を達成することはできない.そのため,センサモジュールは電池動作とする必要がある.
患者の生体情報の連続監視を円滑に行い,フィードバック治療を中断なく行うためには,電池を取り換えることなく,可能な限り連続動作を行うことが必要である.
一方で,生体が暴露される電磁波の量(SAR,電力比吸収率)を規制値以下に抑える必要があることから,通信の伝送電力を一定値以下に設定する必要がある.
前述のように耐干渉性の観点から,フィードバック治療には広帯域拡散通信が必須と思われるが,特に各周波数での送信電力が著しく小さいUWB(UltraWide Band)による通信の使用が望ましいと考えられる.UWBの中でも特に搬送波を用いないUWB-IR(Impulse Radio)方式が消費電力を更に抑えられることから,その使用が検討されている.
2.1.2から2.1.5に述べたフィードバック治療における通信の要件は互いにトレードオフの関係にあるために,各事例に応じて最適化を行う必要がある.
耐干渉性を向上するためには送信電力を増加させればよいが,他の機器の耐干渉性を損なわせる.また,消費電力や伝送電力を増加させてしまい,電池の取換えの頻度が増え,生体が暴露される電磁波の規制値を超えるおそれがある.
耐干渉性の観点から通信を広帯域化することは,同時に通信速度を向上させるため,通信の低遅延性の必要条件の一つとも考えられる.
一方で,エラー時の再送によって耐干渉性を向上させる方法については,低遅延性を確保するために,再送の回数が限られることに留意しなければならない.
このように,高度な医療におけるフィードバック自動治療に求められる無線通信の要件は,多数の条件を考慮して複雑に最適化を行う必要がある.
ヘルスケア領域における通信の要件については,高度な医療の場合に求められた,耐干渉性,通信速度,低遅延性などは大きな問題とはならない.
一方で,ヘルスケア領域においても(測定頻度は少なくなるものの),年単位で連続して測定を繰り返すことによって意味のあるデータを収集できるので,消費電力や伝送電力をできるだけ小さくして,使用機器の電池消耗を抑えた方がよいと考えられる.
多くの場合,緊急性のあるデータも少ないので低遅延性については全く問題とならないことから,複数のデータをまとめて送信することで電力を節減することも可能と考えられる.この場合は利用者の利便性とのトレードオフとなる.また同じ場所に非常に多人数が集まった際のデータ収集にも,支障がないことが求められる(3).
更にヘルスケアにおいては,ほぼ正常者を対象としており,非常に多数の対象者の情報を集約するために,情報のセキュリティの問題がより重要である.
医療記録(カルテ情報,レセプト情報,死因などの医療統計情報など)は多数の対象者の情報を収集することができ,ビッグデータの一つである.これらの情報は間欠的な情報であったり,対象者ごとに情報の種類がまちまちであったりするために,これまではごく限られた解析しか行われていなかった.しかし,ビッグデータを効率的に使用しなければ,今後の医療の発展に障害があることが明らかになってきた.
新しい医薬品や医療機器の開発時には,患者で一般的に使用する前に,同意を得た一部の患者のみで安全性と有効性を調べることが必要であり,これを治験と呼んでいる.治験では,実施前に決めた測定項目を可能な限り漏れなく収集するために,効率的な統計解析が可能となっており,医薬品や医療機器の効果の最も確実な証拠の基礎となっている.
近年,治験に必要とされる患者人数が増え,数千人を必要とする治験も実際に行われている.この治験には非常に大きな開発費用を用いるために,治験の結果次第で製薬会社や医療機器メーカの業績が大きく変わるほどである.このことにより,企業は積極的な開発への投資を控え,近年,実用化される医薬品や医療機器の品数が少なくなっている.
一方で,一部の患者のみに有効な薬剤も開発されているが,どのような属性を持つ患者に有効であるかの同定も必要となっている(個別化医療).未知の属性を同定する必要がある場合もあり,個別化医療の対象の特定は従来の治験では難しいと考えられている.このような背景から,ビッグデータによる解析が今後,必須となると考えられている.
今後ヘルスケア機器による連続的な情報収集により,また多くの正常者を含む一般の集団からの情報を広く集めることにより,更に有効なビッグデータが収集できるものと期待される.
従来,ヘルスケアの増進や病気の予防法の検討のために正常者のデータを収集することは,臨床研究の類型とされ「人を対象とする医学系研究に関する倫理指針」の適応を受け,倫理審査委員会の承認を受け行われてきた.これまで匿名化したデータに関しては,明示の同意がなくても収集が可能であった.しかし個人情報保護法の改正により,匿名化したデータであっても(病歴などを含む場合は)個人情報を収集することについての同意を得ることが必要になった.多くの他のビッグデータ収集と同様に,収集した情報のセキュリティ対策はより重要となっている.
本章ではフィードバック治療による,医療の高度化の実例を示し,2.1で述べた通信の要件について再考する.本実例では,急性心不全において起こる,血圧の変動,全身への血流の低下,肺への血液貯留による呼吸困難に対し,4種類の薬剤を使用し,これらを同時に30分程度の間に,自動で安定して正常化する装置を示す(4)~(6).
1.で述べたとおり,情報は収集するのみでなく,解析することによって有用な情報となる.心不全では,血圧の変動,心拍出量(全身への血流)の低下,左心房圧(肺への血液貯留すなわち呼吸困難の指標)の増加が同時に起こり,これらは血圧,心拍出量,左心房圧を連続モニタすることで,その経過や程度を数量化できる.
しかしながらこれらの測定変数を直接にフィードバックの制御対象変数として制御を行うのは非常に困難であった.三つの変数のうち血圧と心拍出量の二つのみを対象とした既存研究でも十分な精度での制御は行うことができなかった.その理由として,制御に用いる薬剤は複数の変数に対しての作用を有するため,一つの操作量が複数変数に影響するモデルに基づく多次元のフィードバック制御が必要であるためと考えられた.しかしながら多操作量―多変数の関係を定量化する行列の同定は困難であり,症例ごとに差異もあることが明らかになった.
循環器系を包括的にモデル化する拡張ガイトン理論を用いると,血圧,心拍出量,左心房圧の測定変数から循環器系の内部特性を表す心ポンプ機能,血管抵抗,負荷血液量を数値的に算出可能であるので,これらをそれぞれ改善させる強心薬(ドブタミン),血管拡張薬(ニトロプルシド),輸液及び利尿薬(フロセミド)を用いた三つの独立したフィードバック制御が可能となる.
上述の制御戦略を基に,急性心不全のフィードバック自動治療装置を開発した.図1はその動作原理を示したものである.この装置の目的は,測定変数(血圧,心拍出量,左心房圧)を正常化して生命を維持することである.しかし測定変数の直接の制御ではなく,解析で得られた内部特性をそれぞれ最も適した薬剤で正常化する.このようにフィードバックの制御対象を適切に選ぶことにより,比例積分制御(心ポンプ機能,血管抵抗)や制御時点の瞬時特性値のみを用いた非線形制御(負荷血液量)のような極めて単純な制御方法によって,これら三つのフィードバック制御は可能となった.
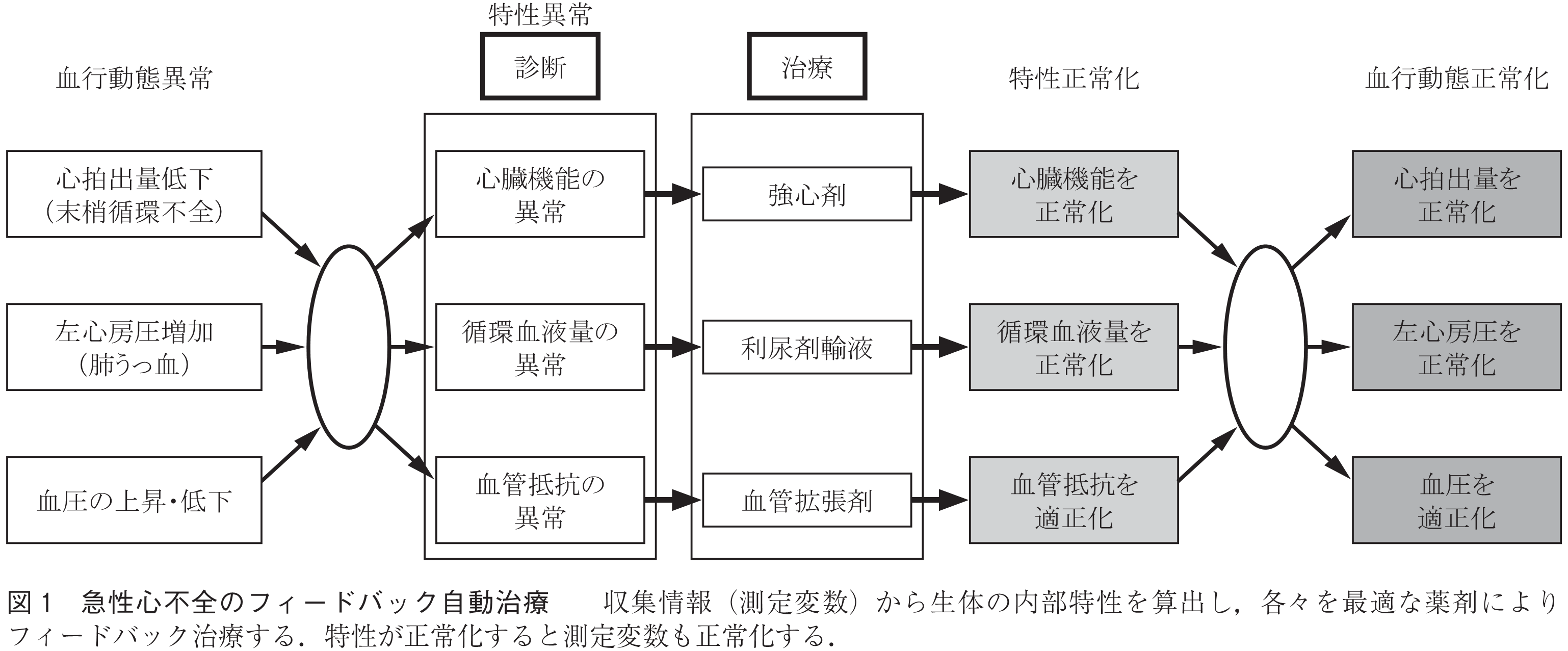
図2は開発したフィードバック自動治療装置の動作例を示したものである.実験動物として犬を用い,冠動脈内にガラス微粒子を注入することによって作成した急性心不全モデルでその動作を確認した.
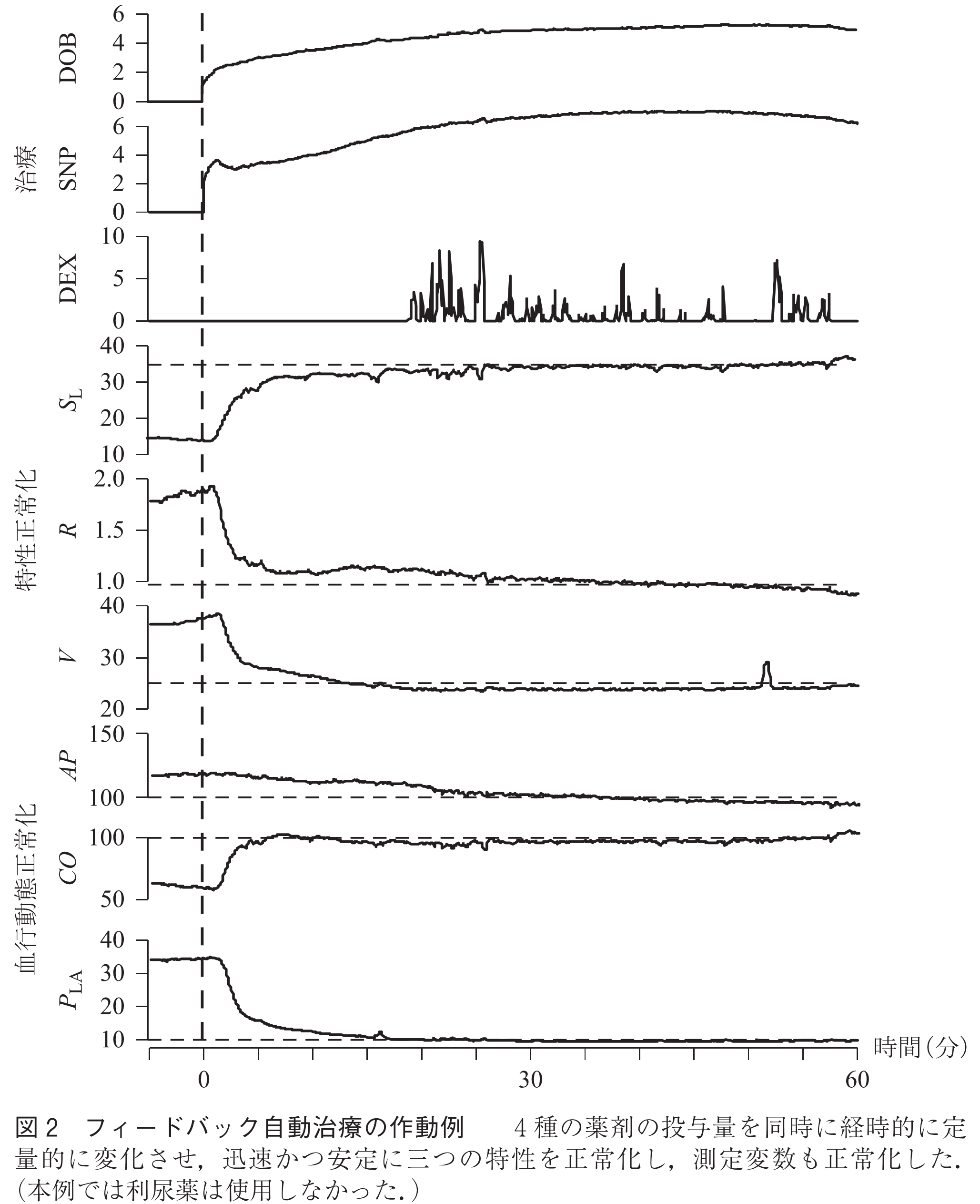
図2は上段から治療に使用した三つの薬剤の投与量(強心剤・ドブタミン=DOB,血管拡張薬・ニトロプルシド=SNP,輸液・低分子デキストラン=DEX),内部特性の変化,測定変数(血圧=,心拍出量=
,左心房圧=
)の変化を示す.
治療を開始する(時刻0)と,三つの各薬剤について投与量が時間ごとに計算され,薬剤はシリンジポンプを用いて投与された.図2の中段で示すように内部特性(心ポンプ機能=,血管抵抗=
,負荷血液量=
)はいずれも30分以内に同時に正常化し,その制御は迅速であるばかりではなく,振動などを含む不安定な制御の経過もなかった.結果的に血圧,心拍出量,左心房圧の三つの測定変数は同様に30分以内に正常化した.同様の実験は犬8頭で行い,いずれも同様の結果を得た.
上記のフィードバック自動治療装置は測定変数を正常化し,全身の潅流や肺での酸素交換を正常化する.しかしこの装置だけでは急性心不全で障害されている心臓そのものの治療は行うことができない.心臓の仕事や酸素消費量は測定変数から計算することができるが,これらを減らすことは心臓を保護し,心臓の回復をもたらす.心臓での仕事を減らしながらも全身の潅流や肺での酸素交換を保つことができるかどうかは知られていなかった.
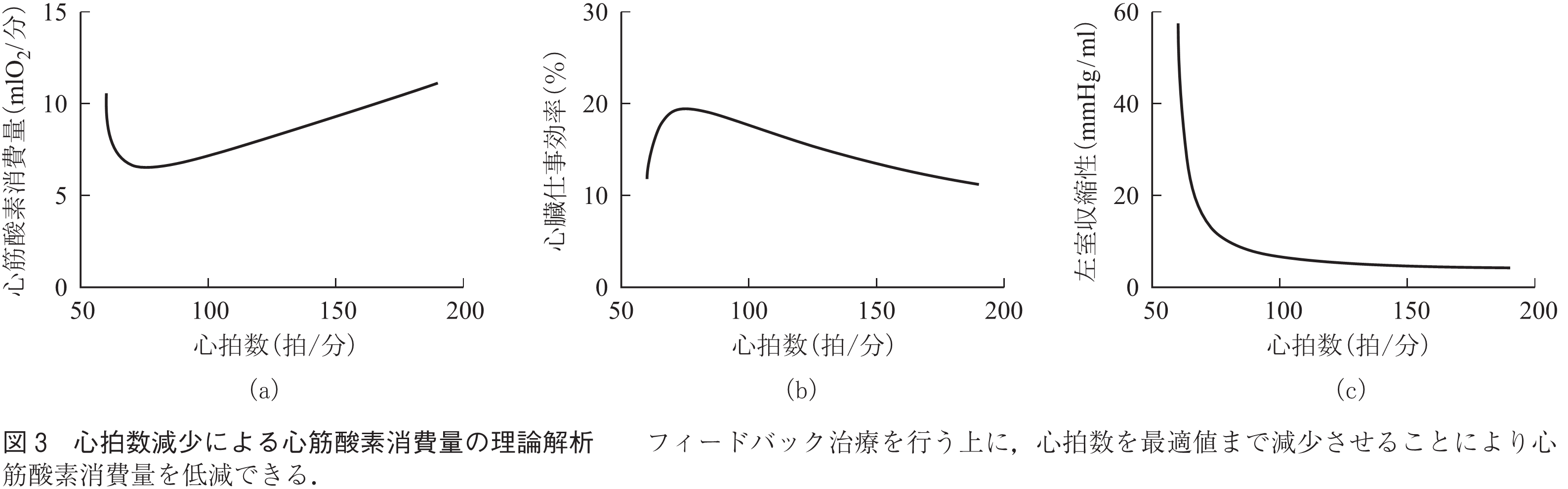
近年,開発された心拍数を減少させる薬剤(徐脈薬)を用いることで心臓の酸素消費量を減少させられるかどうかを理論的及び実験的に検討した.徐脈薬のみを使うと全身の潅流や肺での酸素交換が犠牲になるが,同時にフィードバック自動治療装置を用いることで,全身の潅流や肺での酸素交換と心保護を両立できる可能性がある.
図3は,これを理論的に検討したもので,心拍数75拍/分程度までの心拍数の減少では心筋酸素消費量が減少して(図3(a)),心臓の仕事効率は増加した(図3(b)).その際に左室収縮性を増加させる必要があり(図3(c)),強心剤の増量が必要であった.強心剤の増量は酸素消費量を増加させるが,心拍数減少による酸素消費量減少が心拍数75拍/分までは優勢となり,全体として酸素消費量が減少した.動物実験でも同様の結果が得られた.
各患者のその時点の病態に対して最適な治療を行うフィードバック自動治療の研究開発は,まだ始まったばかりであるが,重要な役割を果たす無線通信についての基礎研究は進んでいる.生理学的な研究やビッグデータ解析には引き続き研究を必要とするが,フィードバック自動治療の実現は近未来に実現するものと考えられる.
(1) M. Sugimachi, T. Kawada, and K. Uemura, “Telemetry and telestimulation via implanted devices necessary in long-term experiments using conscious untethered animals for the development of new medical treatments,” IEICE Trans. Commun., vol.E93-B, no.4, pp.796-801, April 2010.
(2) 原 晋介,“ヘルスケア・医療情報通信技術,”電子情報通信学会100年史,トピックス,電子情報通信学会,2017.
(3) S. Hara, H. Okuhata, T. Kawabata, H. Nakamura, and H. Yomo, “Real-time vital monitoring for persons during exercises―solutions and challenges―,” IEICE Trans. Commun., vol.E99-B, no.3, pp.556-564, March 2016.
(4) K. Uemura, A. Kamiya, I. Hidaka, T. Kawada, S. Shimizu, T. Shishido, M. Yoshizawa, M. Sugimachi, and K. Sunagawa, “Automated drug delivery system to control systemic arterial pressure, cardiac output, and left heart filling pressure in acute decompensated heart failure,” J. Appl. Physiol., vol.100, no.4, pp.1278-1286, April 2006.
(5) K. Uemura, K. Sunagawa, and M. Sugimachi, “Computationally managed bradycardia improved cardiac energetics while restoring normal hemodynamics in heart failure,” Ann. Biomed. Eng., vol.37, no.1, pp.82-93, Jan. 2009.
(6) K. Uemura, T. Kawada, C. Zheng, and M. Sugimachi, “Less invasive and inotrope-reduction approach to automated closed-loop control of hemodynamics in decompensated heart failure,” IEEE Trans. Biomed. Eng., vol.63, no.8, pp.1699-1708, Aug. 2016.
(平成29年4月4日受付 平成29年4月19日最終受付)
続きを読みたい方は、以下のリンクより電子情報通信学会の学会誌の購読もしくは学会に入会登録することで読めるようになります。 また、会員になると豊富な豪華特典が付いてきます。
電子情報通信学会 - IEICE会誌はモバイルでお読みいただけます。
電子情報通信学会 - IEICE会誌アプリをダウンロード